Conteúdos
– Solução, concentração e diluição
Objetivos
– Compreender o conceito de solução
– Conceituar “diluição” e “concentração”
1ª Etapa: Início de conversa
A química é uma ciência cujo objeto de estudo são os materiais e as substâncias. É possível estudá-la em três perspectivas: constituição, propriedades e transformação. Esses estudos podem ser feitos em três níveis de representação: macroscópico, submicroscópico e simbólico. O tema dessa aula pautará uma propriedade importante, a concentração. Para isso, o(a) professor(a) fará uso, com os alunos, do Objeto Virtual de Aprendizagem (OVA) Concentração, elaborado pela PhET Interactive Simulations.
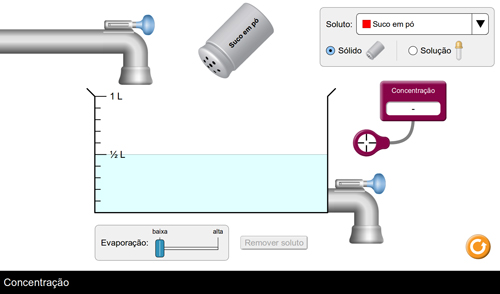
Figura 1. Tela inicial do OVA Concentração
Para início, é importante que o(a) professor(a) retome o conceito de solução como mistura homogênea, isto é, que apresenta uma única fase – de duas ou mais substâncias – sendo que a substância dissolvida é chamada de soluto e a que dissolve é o solvente. Concentração é um indicativo de composição de uma mistura, geralmente expressa como a razão entre a quantidade de uma substância e o volume da mistura.
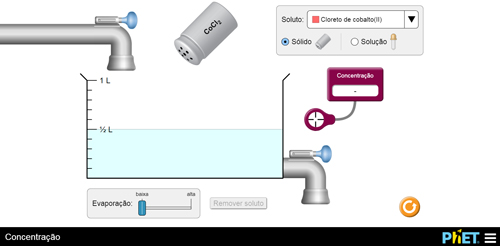
Para simular o preparo de uma solução basta escolher um dos solutos, no caso, cloreto de cobalto II (FIGURA 2A), que, ao ser agitado, deposita soluto no recipiente onde está o solvente. Com o auxílio de um leitor, poderá ser verificado o valor da concentração em mol/L da solução (FIGURA 2B).
A
B
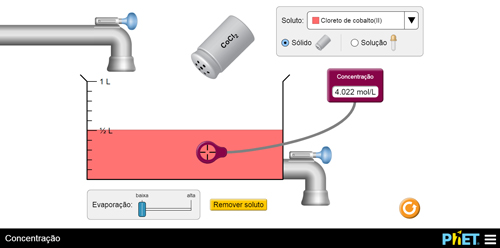
Figura 2. Concentração: A – seleção do soluto; B – solução preparada.
2ª Etapa: Explorando conceitos
Na segunda etapa da aula, o(a) professor(a) irá explorar conceitos de “solução saturada”, “concentrar”, “diluir” e “retirar uma alíquota”. Para isso, o(a) estudante deverá manipular o OVA sempre observando a leitura do valor de concentração. O princípio-chave adotado nesse plano de aula será “fazer-conceituar-refazer”.
a) solução saturada
Prepare uma solução adicionando indiscriminadamente o soluto. Quando aparecer a observação “Saturado!”, peça para que os alunos analisem a deposição de sólido no fundo do recipiente e a não-alteração do valor da concentração da solução (FIGURA 3).
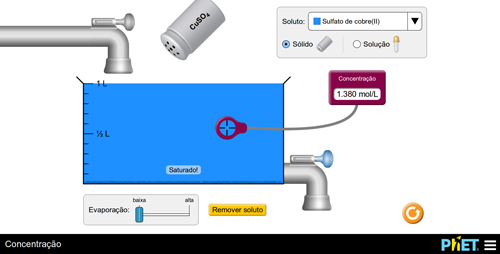
Figura 3. Preparação de uma solução saturada com corpo de fundo.
Após a identificação do corpo de fundo, o(a) professor(a) deverá conceituar que uma solução é saturada quando contém uma quantidade máxima de soluto para determinada quantidade de solvente, de modo que o sistema resultante tenha uma única fase. Os(As) alunos(as), então, repetirão o experimento e observarão que substâncias diferentes possuem solubilidades diferentes.
b) concentrar uma solução
Prepare uma solução adicionando o soluto e meça o valor da concentração. Em seguida, instigue os alunos a aumentarem o valor da concentração por dois modos distintos. Os alunos devem obter as seguintes conclusões: a) adicionando soluto (FIGURA 4); b) evaporando solvente (FIGURA 5).
A
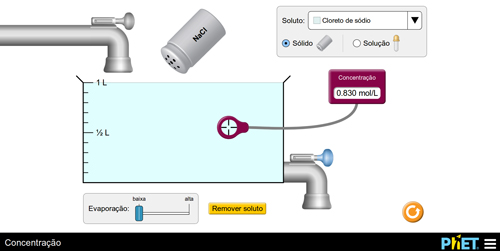
B
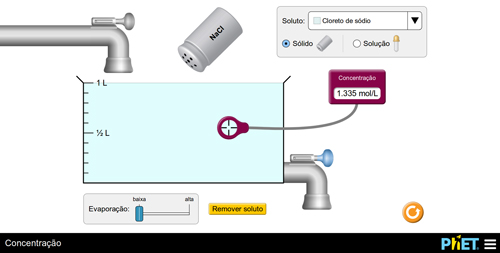
Figura 4. Aumento da concentração via adição de soluto.
A
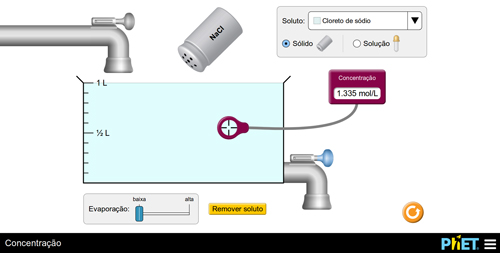
B
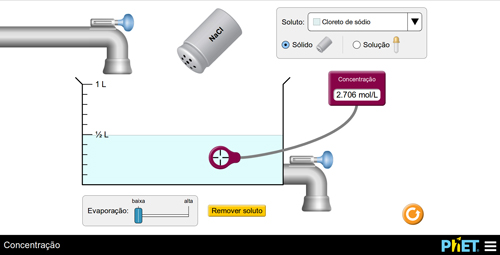
Figura 5. Aumento da concentração via redução de solvente (por evaporação).
O(a) professor(a) poderá explicar o fenômeno, por exemplo, pela relação matemática. Se C = n/V, ao aumentar o numerador ou diminuir o denominador, o resultado final será maior. Os(as) alunos(as), então, poderão repetir o experimento para fixar aquilo que aprenderam.
c) diluir uma solução
Prepare uma solução adicionando o soluto e meça o valor da concentração. Em seguida, instigue os alunos a diminuírem o valor da concentração. Os alunos devem concluir que, para executar tal tarefa, é necessário aumentar a quantidade de solvente (FIGURA 6).
A
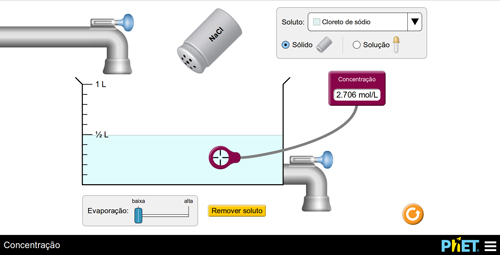
B
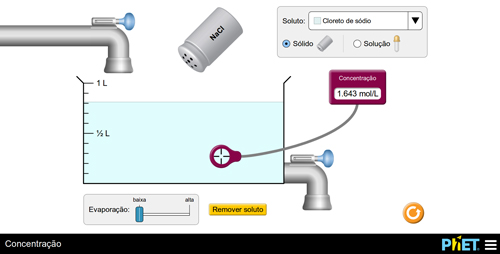
Figura 6. Aumento da concentração via adição de soluto.
O(a) professor(a) poderá explicar o fenômeno, por exemplo, pela relação matemática. Se C = n/V, ao aumentar o denominador, isto é, o volume da solução, o resultado final será menor. Os(as) alunos(as), então, poderão repetir o experimento para fixar aquilo que aprenderam.
3ª Etapa: Finalizando a discussão
Para finalizar a aula, uma vez que os conceitos foram trabalhados, o/a professor/a poderá fazer alguns exercícios com os alunos. Seguem algumas sugestões com as respectivas respostas:
1. (PUC – Adaptado) Foram totalmente dissolvidos em 100 ml de ácido clorídrico 6,54 gramas de zinco. Supondo não haver variação de volume da solução, qual é a concentração em mol/L da solução final em cloreto de zinco? Dado: Zn = 65,4
a) 0,1 mol/L
b) 0,2 mol/L
c) 1 mol/L
d) 2 mol/L
e) 10 mol/L
Resposta correta: C
2. (MED – ITAJUBA – Adaptado) Quantos gramas de Na3PO4 (MM = 164) são necessárias para preparar 5,0 litros de uma solução 3 mol/L?
a) 10,9
b) 65,6
c) 98,4
d) 273
e) 2460
Resposta correta: E
3. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA – Adaptado) A concentração de ácido acético (C2H4O2) no vinagre é da ordem de 0,83 mol/L. Aproximadamente, quantos gramas desse ácido há em 1 litro de vinagre? Dados: C = 12; H = 1; O =16
a) 10 g
b) 20 g
c) 30 g
d) 40 g
e) 50 g
Resposta correta: E
Materiais Relacionados
Recomenda-se que o(a) professor(a) acesse algum material preliminar para conhecer um pouco mais sobre concentração e experimentação virtual no ensino de química:
1 – “A Química tem solução!”. Acesso em 03 de setembro de 2018.
2 – “Concentrações”. Acesso em 03 de setembro de 2018.
3 – “Soluções Químicas: Desenvolvimento, Utilização e Avaliação de um Software Educacional”. Acesso em 03 de setembro de 2018.
4 – “Como os estudantes concebem a formação de soluções”. Acesso em 03 de setembro de 2018.

